 「D360」は5年ほど前に開発されたシステムで、欧米では20数社に導入実績があり、エンドユーザーは数千人の規模に達している。メガファーマだけでなく、小規模なバイオ企業にも採用されているという。
「D360」は5年ほど前に開発されたシステムで、欧米では20数社に導入実績があり、エンドユーザーは数千人の規模に達している。メガファーマだけでなく、小規模なバイオ企業にも採用されているという。
サターラが医薬品開発向け研究データ統合ソリューション
複数ソースから自在に検索・可視化、規制当局の照会に迅速対応
2014.10.17−サターラ(Certara)は、医薬品開発における分散したデータソースを統合し、透過的に検索・解析・可視化できるようにする統合ソリューション「D360」を日本市場で本格的に販売開始した。おもに新薬の探索研究から非臨床試験までのプロセスをカバーするもので、欧米では規制当局からの照会事項に回答するために、過去の試験データを手早くまとめることができるとして注目されている。手作業で数日から数週間かかっていたものが、数分から数時間に短縮することが可能。当局への申請データの電子化を推進するCDISC標準の採用の動きとも絡んで、国内でも多くの関心を集めそうだ。
 「D360」は5年ほど前に開発されたシステムで、欧米では20数社に導入実績があり、エンドユーザーは数千人の規模に達している。メガファーマだけでなく、小規模なバイオ企業にも採用されているという。
「D360」は5年ほど前に開発されたシステムで、欧米では20数社に導入実績があり、エンドユーザーは数千人の規模に達している。メガファーマだけでなく、小規模なバイオ企業にも採用されているという。
基本的に、異なるアプリケーションやデータベースで別々に管理されているデータを統合し、創薬研究者や安全性・毒性部門などの担当者が、システム部門の手を借りることなく、自分が見たいデータを複数のデータソースから自由に引き出して利用できるようにするもの。“データカタログ”と呼ばれる技術が核になっており、「D360」自体は実データを保持せず、データ間の論理的なつながりをマッピング(テーブルやフィールド間の関係をツリー構造で定義)することで、関連するデータをまとめて提示することができる。検索クエリーの作成も簡単で、データカタログの項目をドラッグ&ドロップするだけ。クエリーを保存しておき、共有・再利用することも可能。リレーショナルデータベース(RDB)やEXCELなどに格納されている構造化データなら、すべてカタログ化することができるという。
とくに、データベース化が遅れている非臨床試験データに対応するため、「D360」のコンパニオン製品として「Pre-Clinical Safety Store」(PCSS)を用意している。これにより、ファイルベースの非臨床試験データを収集、バリデーションし、CDISCのSEND(非臨床データを提出する際のデータ標準)に対応した情報として保存することが可能。「D360」の検索および視覚化・解析機能と組み合わせることで、CRO(医薬品開発受託機関)からのデータと合わせて進行中の試験モニタリング、横断的な試験データ解析が可能になる。既存の試験データをSEND形式に変換することも容易である。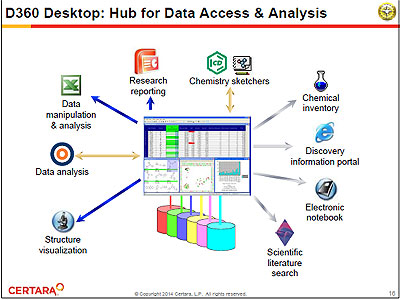
サターラの日本法人では、販売・サポートなどの組織をあらためて整備して万全の体制で普及を図る。データカタログ作成などの技術的なフォローにも力を入れる。とくに、CDISC標準が米食品医薬品局(FDA)では2017年にも義務化される予定となり、日本国内でも検討が始まっていることから、この機を狙って積極的なプロモーションをかけることにしている。
******
<関連リンク>:
サターラ(日本法人トップページ)
http://www.certara.co.jp/
サターラ(D360 製品紹介ページ)
http://www.certara.co.jp/product/D360/