 今回の研究では、核内受容体のレチノイドXレセプター(RXRアルファ)に対するリガンドの9-シスレチノイン酸、また核内受容体レチノイン酸レセプター(RARガンマ)に対するリガンドのオールトランスレチノイン酸(ATRA)−の組み合わせで分子動力学(MD)シミュレーションを実行し、リガンドがアポ体の受容体表面に到達することでホロ体に構造遷移するシミュレーションに成功した。
今回の研究では、核内受容体のレチノイドXレセプター(RXRアルファ)に対するリガンドの9-シスレチノイン酸、また核内受容体レチノイン酸レセプター(RARガンマ)に対するリガンドのオールトランスレチノイン酸(ATRA)−の組み合わせで分子動力学(MD)シミュレーションを実行し、リガンドがアポ体の受容体表面に到達することでホロ体に構造遷移するシミュレーションに成功した。
分子機能研究所が核内受容体の創薬への応用に道
独自の仮説でMDシミュレーションに成功、リガンド認識機構の原理解明
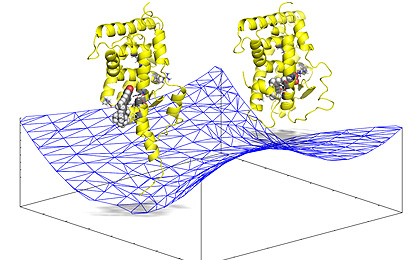
2015.12.29−分子機能研究所(本社・埼玉県三郷市)は、辻一徳(つじもとのり)代表が核内受容体スーパーファミリーにおけるリガンド認識機構の原理の解明に成功し、その成果が「Journal of Molecular Graphics and Modeling」誌に掲載されたと発表した。核内受容体は、リガンドとの結合部位が表面に露出していないことに加え、タンパク質構造全体が結合前のアポ体から結合後のホロ体へと大きな構造変化を起こすなど、そうした働きの原理については謎が多い。辻代表は、独自の"ヘリックスH3三点初期結合仮説"に基づいたコンピューターシミュレーションにより、どのようにリガンドを認識するか、どのようにホロ体への構造変化が起こるか、その動作原理を原子・電子レベルで解明することに成功したという。
 今回の研究では、核内受容体のレチノイドXレセプター(RXRアルファ)に対するリガンドの9-シスレチノイン酸、また核内受容体レチノイン酸レセプター(RARガンマ)に対するリガンドのオールトランスレチノイン酸(ATRA)−の組み合わせで分子動力学(MD)シミュレーションを実行し、リガンドがアポ体の受容体表面に到達することでホロ体に構造遷移するシミュレーションに成功した。
今回の研究では、核内受容体のレチノイドXレセプター(RXRアルファ)に対するリガンドの9-シスレチノイン酸、また核内受容体レチノイン酸レセプター(RARガンマ)に対するリガンドのオールトランスレチノイン酸(ATRA)−の組み合わせで分子動力学(MD)シミュレーションを実行し、リガンドがアポ体の受容体表面に到達することでホロ体に構造遷移するシミュレーションに成功した。
受容体とリガンドとの結合シミュレーションとして、リガンドにタンパク質方向に向かう力をかけてMD計算を実行するターゲッテッドMDあるいはステアードMDと呼ばれる方法がある。ただ、結合部位がタンパク質表面にある場合は解析可能だが、それがタンパク質内部に隠れている核内受容体での成功例はいまだ存在していなかった。
そこで、今回の成功は、辻代表の"ヘリックスH3三点初期結合仮説"を前提条件にしたことがポイントになる。これは、アポ体の特定位置(ヘリックスH3)に、リガンドの形状や大きさを認識する3つの残基からなるリガンドエントリー表面があることを発見したもの。量子化学計算でこの仮説を検証した結果、リガンドが近づくと、エントリー表面の裏側で電荷の再配置が起こり、エントリー表面を構成する極性残基のマイナスチャージが生じてリガンドを引き込むというメカニズムが確認できた。つまり、アポ体からホロ体への構造遷移は、誘起効果によってタンパク質内部の静電ポテンシャルが再構築される過程であることを突きとめたのだという。これは、核内受容体を対象にした結果だが、他のタンパク質のリガンド認識も同様のメカニズムで起こると推定されるとしている。
このシミュレーションは、同社が製品化している創薬支援システム「Homology Modeling Professional for HyperChem」および「Docking Study with HyerChem」で簡単に実施することが可能。アポ体のヘリックスH3の三点にリガンドが結合した状態を初期構造とし、MDを実行すると、ホロ体への遷移を解析することができる。
核内受容体は、ヒトでは48種類が知られているが、がん、難治性疾患や生活習慣病などに対する画期的治療薬の開発に結びつく重要な受容体として注目されてきている。今回の研究成果は、目的の核内受容体に対し、副作用や毒性なく選択的に作用する薬物設計を可能にする技術として、今後の活用が期待される。
******
<関連リンク>:
分子機能研究所(トップページ)
http://www.molfunction.com/jp/
分子機能研究所(核内受容体を標的とした構造ベース薬物設計のためのページ)
http://www.molfunction.com/jp/nuclearreceptor.htm
エルゼビア・サイエンスダイレクト(今回の論文が掲載されているページ)
http://www.sciencedirect.com/science/article/pii/S1093326315300632