 もうひとつは、安全性試験にかかる期間と費用が大きな負担になっているという点だ。新規な化合物を開発したとしても、動物実験などを行って安全性を評価するために約3年の期間が必要であり、総研究費の20%ほどがそれに当てられているといわれている。画期的な機能性化学物質を早期に市場投入し、国際競争力を確保するためには、こうした安全性評価プロセスを加速することが重要な要素になる。
もうひとつは、安全性試験にかかる期間と費用が大きな負担になっているという点だ。新規な化合物を開発したとしても、動物実験などを行って安全性を評価するために約3年の期間が必要であり、総研究費の20%ほどがそれに当てられているといわれている。画期的な機能性化学物質を早期に市場投入し、国際競争力を確保するためには、こうした安全性評価プロセスを加速することが重要な要素になる。
2021年冬CCS特集:第2部総論(技術動向)
次世代型安全性予測AI-SHIPS完成へ
2021.12.01−CCS(コンピューターケミストリーシステム)の世界では、化学物質のさまざまな特性や物性の予測が行われるが、なかでも毒性予測はたいへんニーズが高い半面、技術的には難しい分野であり、長年の開発にもかかわらず、決定版といえるシステムはいまだ生み出されていない。その意味で、経済産業省プロジェクト「次世代型安全性予測手法の開発」(AI-SHIPSプロジェクト)の成果が注目される。いよいよ最終年度も大詰めとなり、年内にはシステムが完成する予定だ。そのユニークな発想と予測精度の高さで、国際的な評価も高まっている。プロジェクト終了後も、貴重な国の財産として育てて広め、活用を図ることが重要だろう。
◇ ◇ ◇
◆◆毒性試験の費用と期間削減、来年2月に成果報告会◆◆
毒性予測に関する社会的要請は今後ますます強まると予想される。その背景のひとつは国際的な動物愛護の理念である3Rの原則(動物実験の代替、削減、改善)の徹底が求められてきていること。すでに欧州の化粧品分野では、その原料も含めて動物実験が禁止されている。将来的にはあらゆる分野で、動物実験で安全性を評価した化学物質を含む製品は、市場で買ってもらえなくなる可能性もある。
 もうひとつは、安全性試験にかかる期間と費用が大きな負担になっているという点だ。新規な化合物を開発したとしても、動物実験などを行って安全性を評価するために約3年の期間が必要であり、総研究費の20%ほどがそれに当てられているといわれている。画期的な機能性化学物質を早期に市場投入し、国際競争力を確保するためには、こうした安全性評価プロセスを加速することが重要な要素になる。
もうひとつは、安全性試験にかかる期間と費用が大きな負担になっているという点だ。新規な化合物を開発したとしても、動物実験などを行って安全性を評価するために約3年の期間が必要であり、総研究費の20%ほどがそれに当てられているといわれている。画期的な機能性化学物質を早期に市場投入し、国際競争力を確保するためには、こうした安全性評価プロセスを加速することが重要な要素になる。
AI-SHIPSでは、一般工業用化学品を対象に、化審法28日間反復投与試験における肝毒性(細胞障害、脂質異常、胆管障害および肝肥大など)とそのリスクの程度、それに加えて血液毒性と腎毒性を予測できるシステムを目指して開発がスタートした。正式名称は、経済産業省研究開発事業「省エネ型電子デバイス材料の評価技術の開発事業『機能性材料の社会実装を支える高速・高効率な安全性評価技術の開発−毒性関連ビッグデータを用いた人工知能による次世代型安全性予測手法の開発』」で、2017年6月からスタートし、来年3月に期限を迎える。
プロジェクトリーダーは、奈良先端科学技術大学院大学・データ駆動型サイエンス創造センターの船津公人特任教授(東京大学名誉教授)で、昭和薬科大学、静岡県立大学、明治薬科大学、名古屋市立大学、産業総合研究所、化学物質評価研究機構、システム計画研究所、みずほリサーチ&テクノロジーズの9機関が参画。システム開発チーム、インビトロ実験チーム、予測モデル開発チームなどに分かれて研究を進めてきた。昨年にはユーザーコンソーシアムを発足させ、システムのトライアル使用を行ってもらうとともに、改善への要求の声なども聞き、システムのブラッシュアップに反映させたという。こちらには民間企業を中心に16社/機関が参加している。
開発はまさに大詰めであり、システムは現時点でほぼ完成形となっている。11月にはオンライン開催されたOECD(経済協力開発機構)のQSARツールボックスマネジメントグループ会合に経産省とともに参加し、AI-SHIPSを紹介する機会を持った。考え方が画期的であり、操作性もユーザーフレンドリーだとして、この分野の海外の研究者から高い評価を得たという。国内では、来年2月21日に最終成果報告会を兼ねた「AI-SHIPSシンポジウム」を開催し、大々的に披露する計画である。
◇ ◇ ◇
◆◆世界初の3層モデルを搭載、毒性発現機構を考慮し予測◆◆
従来の構造活性相関(QSAR)による毒性予測は、分子構造と毒性との関係を直接モデル化したもので、学習に使用したデータセットと異なる系統の化合物に対しては信頼性のある予測ができなくなることが多く、全体としても予測精度は低かった。とくに、どのような理由(機序)で毒性が発現するかがモデルとしてブラックボックスになってしまい、予測結果を手放しで受け入れることは難しかった。これに対し、AI-SHIPSでは、船津教授が世界で初めて提唱した“3層モデル”を組み込んだところに革新性がある。生体内のADME(吸収・分布・代謝・排出)を考慮した動態学的アプローチと、遺伝子発現や細胞内のタンパク質の活性に基づく分子生物反応的アプローチ、さらにAI的アプローチを統合。これにより、毒性発現メカニズムを考慮したAOP(有害性発現経路)ベースの毒性予測を可能にしている。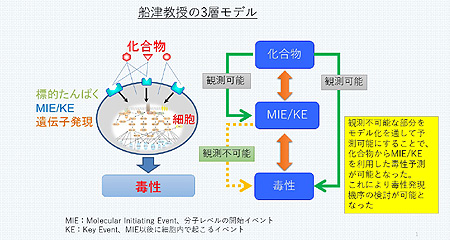
まず、化合物の体内での吸収や分布、蓄積、代謝などを生物学的薬物動態(PBPK)モデルで精密に予測。次に、細胞内での核内受容体、ストレス応答パスウェイ、薬物代謝などのさまざまな生化学的イベントを介した機械学習モデルを構築することにより、毒性発現においてキーとなる要因を評価した。化合物が生体分子との間で最初のイベント(MIE)を起こし、そのあと毒性発現につながるような生体でのキーイベント(KE)が発生する。MIE/KEはインビトロ(試験管内)試験で観測できるが、最終的な毒性発現はインビボ(生体内)での評価になるため、そのメカニズムを観測することができない。船津教授の3層モデルでは、観測不可能な部分をモデル化によって予測可能とすることで、インビトロ情報とインビボ情報を関係づけることに成功した。つまり、化合物の体内動態を予測するモデル(1層目)と細胞内イベント(インビトロ)の予測モデル(2層目)を結びつけ、最終的に生体(インビボ)での毒性予測モデル(3層目)を構築することができた。これにより、毒性発現メカニズムの検討も可能になるわけで、実際にプロジェクト遂行の過程で、肝毒性のメカニズムに関する重要な発見や示唆が得られたなど、毒性学にも貢献する成果がみられたという。
また、複雑な毒性予測モデルを構築するデータを集めるため、大量のインビトロ試験を実施したことも、AI-SHIPSプロジェクトの際だった点だろう。研究チームは、製品評価技術基盤機構が運営している有害性評価支援システム統合プラットフォーム「HESS」に登録されている毒性データから約860物質をリストアップするとともに、REACH登録情報などからの化合物を追加して合計約2,200化合物の広範囲なデータを学習用に使用した。そして、実際に約330物質に対してそれぞれ46種類のアッセイを実施。こうした実験で得られた大量のデータを利用し、130種類の予測モデルが構築されたという。
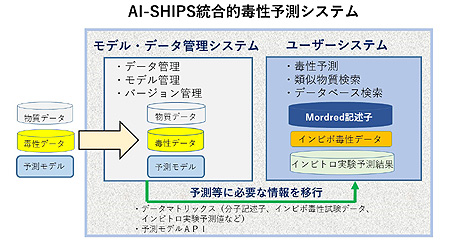
システムの全体イメージを別図に示したが、大きくモデル・データ管理システムと、利用者が操作するユーザーシステムに分かれている。管理システム側には、企業が独自の物質データや毒性データを登録していくことも可能なつくりとなっている。最終的に予測できる毒性モデルは、6つの肝毒性(細胞障害・炎症予測結果、肝機能低下、肝機能亢進、胆管障害、肥大、脂質代謝異常)、腎障害、2つの血液毒性(貧血、凝固異常)となる。予測精度は8割を超えており、悪くても7割以上。従来のシステムよりもかなり高い。とくに、予測のもとになったインビトロ試験データを参照することで、どの体内機序に起因しているかがわかるため、あらためて実験で再評価したい場合でも、効率的に行えるというメリットがある。
プロジェクトリーダーの船津教授は、「毒性発現メカニズムを考慮した毒性予測という世界初のチャレンジに向け、領域が異なる各機関の先生方の持ち味がうまく組み合わさって、たいへん良いものをつくり上げることができた。コンソーシアムに入っている企業のみなさんからの期待も高く、化学産業にとって有用な戦略的ツールになったと思う」と話す。
船津教授はこれまで、CCSを活用して「何をつくるか」「それを実験室でどうつくるか」「商業生産としてどうつくるか」「それは実際にできたか」という視点でさまざまな研究とプロジェクトを推進してきた。「同様な言い方をすれば、今回のAI-SHIPSプロジェクトは『それはつくってもいいのか』になると思う。こうして考えると、物を開発するというのは最終的には環境や人への影響を評価することで完結するといえる」とまとめている。
AI-SHIPSは、経産省プロジェクトによる成果物であり、当初の構想に基づき、高機能化学製品の速やかな市場投入を可能にすることによる化学産業の国際競争力向上という広く高い視点での活用が推進されるべきだろう。最近はマテリアルズ・インフォマティクス(MI)で目的の機能を有する候補化合物を多く得ることができるようになりつつあるが、毒性予測ソフトでスクリーニングすることにより、有望な材料候補を合理的に絞り込むことが可能。動物実験は早晩禁止されるのが世界の流れであり、欧米の後追いではなく、こうした動きを先取りするかたちで毒性予測システムの活用に取り組むことが望ましい。経産省には、産業振興の観点からも積極的な旗振りを期待したい。